Electrólisis
 |
Autores: Silvia Cerdeira, Helena Ceretti y
Eduardo Reciulschi. Responsable disciplinar:
Silvia Blaustein. Área disciplinar:
Química. Temática: Aplicación de reacciones
de óxido-reducción: electrólisis. Nivel:
Secundario, ciclo básico. Secuencia didáctica
elaborada por Educ.ar. |
|---|
Propósitos generales
• Promover el uso de los equipos portátiles en el proceso de enseñanza y aprendizaje.• Promover el trabajo en red y colaborativo, la discusión y el intercambio entre pares, la realización en conjunto de la propuesta, la autonomía de los alumnos y el rol del docente como orientador y facilitador del trabajo.
• Estimular la búsqueda y selección crítica de información proveniente de diferentes soportes, la evaluación y validación, el procesamiento, la jerarquización, la crítica y la interpretación.
Introducción a las actividades
Viajen con su imaginación hacia principios del siglo XIX. ¿Qué científicos vivieron en aquel tiempo? ¿Qué investigaciones realizaban? Revisando la historia de las Ciencias Naturales, y de la Química en particular, encontramos que Dalton y Gay-Lussac experimentaron con gases para conocer más a fondo la estructura de la materia y establecer algunas leyes de la Química. Paralelamente, otros investigadores estudiaron los efectos de la electricidad sobre la materia.
En el año 1800 los ingleses William Nicholson y Anthony Carlisle hicieron pasar una corriente eléctrica a través de dos cables sumergidos en un recipiente con agua e iones disueltos capaces de transportar carga. La electrólisis del agua (H2O), una sustancia compuesta, produjo hidrógeno (H2) y oxígeno (O2), dos sustancias simples. Un año más tarde, Humphry Davy electrolizó álcalis fundidos (NaOH, KOH) y obtuvo por primera vez los metales alcalinos sodio (Na) y potasio (K). El mismo método le permitió obtener los metales alcalino-térreos calcio (Ca), estroncio (Sr) y bario (Ba). Gracias a las experiencias de electrólisis, hacia mediados del siglo XIX se habían obtenido y caracterizado alrededor de 70 elementos de la Tabla Periódica.
En 1887, Hall y Héroult obtuvieron aluminio haciendo circular una corriente eléctrica a través de alúmina (Al2O3) fundida. Este método electrolítico marcó el inicio de la producción industrial de dicho metal.
Esta breve referencia histórica pone de manifiesto la importancia científica y tecnológica de los procesos electrolíticos. Avancemos, entonces, hacia su descripción, comprensión y aplicación.
Objetivos de las actividades
Que los alumnos:
• apliquen los conocimientos sobre reacciones de transferencia de electrones, para comprender un proceso de interés tecnológico e industrial: la electrólisis;• vean a escala de laboratorio la aplicación de la electrólisis para obtener productos químicos;
• ejemplifiquen la aplicación de la electrólisis para el recubrimiento superficial de objetos;
• comprendan las diferencias entre pilas y electrólisis.
Actividad 1. Obtención de productos químicos por electrólisis
La electrólisis es un método electroquímico mediante el cual se realiza un trabajo eléctrico sobre un sistema químico, una solución que contiene iones disueltos o un compuesto iónico fundido. Este trabajo eléctrico es necesario para producir ciertas reacciones químicas.
¿Qué tienen en común un sólido iónico fundido y una solución acuosa de una sal u otro compuesto iónico? Ambos sistemas líquidos poseen una cantidad apreciable de iones (cationes y aniones). Cuando las partículas cargadas se mueven, transportan carga, es decir, conducen la corriente eléctrica. Esas partículas pueden ser electrones deslocalizados (es el caso de los metales) o iones que se mueven libremente (soluciones de electrolitos o sólidos iónicos fundidos).
a) Pregunta de desafío: ¿un compuesto iónico, por ejemplo NaCl, en estado sólido, será un buen conductor de la electricidad?
Ahora bien, ¿qué sucede cuando se entrega trabajo eléctrico al
agua? ¿Se producirá una reacción de óxido-reducción?
El agua (H2O) es una sustancia covalente, entonces, si se
conectan dos electrodos a un recipiente que contiene agua «pura» (en
la práctica agua destilada o desionizada), no habrá suficiente
cantidad de partículas cargadas capaces de conducir la corriente
eléctrica. En cambio, si se reemplaza el agua «pura»
por agua de la canilla (agua de red, agua de pozo) o se agrega algún
electrolito (por ejemplo, una pequeña cantidad de sulfato de sodio, o
ácido acético), podrá ocurrir la siguiente reacción:
2 H2O (l) → 2 H2 (g) + O2 (g) (1).
b) Con la ayuda de una Tabla Periódica, asignen números de oxidación y verifiquen que la reacción sea redox.
- Recuerden que la especie química que pierde electrones se oxida, mientras que la especie química que gana electrones se reduce.
- Indiquen quién se oxida y quién se reduce en la reacción (1).
c) Inspirados en el experimento de Nicholson y Carlisle, hagan una electrólisis de agua.
Materiales
• 1 recipiente de vidrio transparente (vaso de precipitados o frasco de mermelada).• 2 trozos de lámina de aluminio o de cobre (aproximadamente 2 x 5 cm) o 2 trozos de grafito (minas de lápiz).
• 2 cables con conectores tipo cocodrilo en sus extremos (si es posible, que sean de diferente color para identificarlos).
• 1 batería de 9 volts.
• Cinta adhesiva.
• Agua de red, agua de pozo o agua destilada con agregado de vinagre, sulfato de sodio, nitrato de sodio o potasio.
• Fenolftaleína (solución al 1% en etanol, o usar un chicle laxante que contenga dicha sustancia en su composición).
Procedimiento
- Coloquen el agua en el vaso hasta aproximadamente la mitad de su capacidad, y agreguen unas gotas de solución de fenolftaleína.
- Sumerjan las láminas de metal o los trozos de grafito en el recipiente con agua. Eviten que se toquen entre sí (pueden fijarse a los bordes del recipiente empleando la cinta adhesiva).
- Conecten cada uno de los extremos de los cables a ambos materiales. Eviten que la punta conectora quede sumergida en el agua.
- Conecten el extremo libre de cada cable a los terminales de una batería de 9 V durante un par de minutos.
- Registren todas las observaciones. Filmen el experimento usando la cámara de video del programa WebCam Companion de sus equipos portátiles.
La fenolftaleína es un indicador ácido-base que tiene color rosa en medio básico, y es incoloro en medio ácido o neutro. En las cercanías del electrodo donde se libera H2 (g) se observará un color rosa, dado que se consumen iones H3O+ y hay un exceso de OH-.
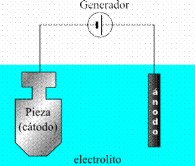
En una electrólisis, en el cátodo tiene lugar la reducción y se le asigna signo negativo (-). El electrodo donde tiene lugar la oxidación es el ánodo y se le asigna signo positivo (+).
d) Empleen el programa Draw o Paint y hagan un esquema de la celda electrolítica ejemplificando la electrólisis del agua. Coloquen el nombre a los electrodos, indiquen su signo y los productos que se obtienen en cada uno.
e) Otras sustancias que se obtienen por electrólisis.
Los experimentos de Davy, o el proceso Hall-Héroult, muestran que la electrólisis se aplica también para obtener sustancias químicas de interés tecnológico e industrial. El cloro gaseoso (Cl2 (g)) y el aluminio metálico son algunos ejemplos.
f) Si disponen de conexión a internet, busquen información de sustancias químicas que se obtengan industrialmente por electrólisis. Indiquen las materias primas que se utilizan.
g) Empleen el programa Draw o Paint de sus equipos portátiles y hagan un esquema de la Tabla Periódica. Indiquen cuáles de las sustancias puras asociadas a los elementos se obtienen por electrólisis.
Actividad 2. Electrodeposición
El pasaje de corriente eléctrica a través de una solución que contiene iones metálicos (por ejemplo Cu2+) se puede aplicar para producir un depósito metálico (en este ejemplo se depositaría Cu) sobre una superficie que actúe como cátodo (recuerden que en el cátodo ocurre la reducción). Este proceso se denomina electrodeposición. Es una técnica muy empleada industrialmente pues permite mejorar las propiedades superficiales de muchos materiales. Se la emplea con fines estéticos, protectivos (resistencia a la corrosión), etcétera.
a) Algunos términos asociados a los procesos de electrodeposición son: cromado, zincado, niquelado, cobreado. ¿Qué sustancias químicas podrían emplearse para hacer estos procesos?b) Busquen información focalizada en las aplicaciones de dichos procesos. Con la información que encuentren, elaboren una tabla empleando el programa Writer o Word de sus equipos portátiles. Mencionen las industrias que emplean dichos procesos en alguna etapa de la fabricación de sus productos (por ejemplo, la industria automotriz en autopartes).
Actividad 3. Comparando procesos electroquímicos
Las pilas y la electrólisis son dos aplicaciones electroquímicas de procesos de transferencia de electrones. En el primer caso, se aprovecha una reacción de óxido-reducción (redox) que ocurre espontáneamente para obtener trabajo eléctrico; en el segundo caso, se hace trabajo eléctrico para producir una reacción de redox no espontánea.
Utilicen el procesador de texto de sus equipos portátiles y hagan una tabla para comparar ambos procesos. Remarquen las similitudes y las diferencias entre ellos, e incluyan sus aplicaciones.
Bibliografía y webgrafía recomendadas
ALDABE, S., ARAMENDÍA, P., LACREU, L. (1999). Química I. Fundamentos. Buenos Aires: Colihue.
«Electrólisis (produciendo HHO)» (Video que muestra una animación de la electrólisis de NaCl en agua, realizada con el programa Crocodrile Chemistry.)
Electrodeposición (Definición de electrodeposición, esquema de una celda, aplicaciones.)