Calor y temperatura. Calor específico
 |
Autores: Fernanda Velázquez y Hernán Ferrari
Responsable disciplinar: Silvia Blaustein
Área disciplinar: Física
Temática: Energía térmica. Definición de calor. Capacidad calorífica. Medición de calor
Nivel: Secundario, ciclo básico
Secuencia didáctica elaborada por Educ.ar
|
|---|
Propósitos generales
● Promover el uso de los equipos portátiles en el proceso de enseñanza y aprendizaje.
● Promover el trabajo en red y colaborativo, la discusión y el intercambio entre pares, la realización en conjunto de la propuesta, la autonomía de los alumnos y el rol del docente como orientador y facilitador del trabajo.
●
Estimular la búsqueda y selección crítica de información proveniente de
diferentes soportes, la evaluación y validación, el procesamiento, la
jerarquización, la crítica y la interpretación.
Introducción a las actividades
La energía térmica está asociada al movimiento azaroso de las moléculas. No es posible medir la posición y la velocidad de cada molécula de una sustancia para determinar su energía térmica, pero sí se pueden medir cambios de energía térmica relacionándolos con cambios de temperatura.
La energía térmica perdida o ganada por los objetos se llama calor. La unidad de energía del SI (Sistema Internacional de Unidades), el Joule, es la más utilizada para medir el calor. Existen otras unidades más antiguas que aún se utilizan: las calorías, las kilocalorías y el Btu (British thermal unit o unidad térmica británica). Una caloría (cal) es la cantidad de calor necesaria para elevar la temperatura de un gramo de agua en un grado Celsius.
Objetivo de las actividades
Que los alumnos entiendan el calor como una forma de energía y comprendan la equivalencia entre energía calórica y energía mecánica.
Actividad 1:
El siguiente diagrama representa el experimento realizado por Joule para determinar el equivalente mecánico del calor.
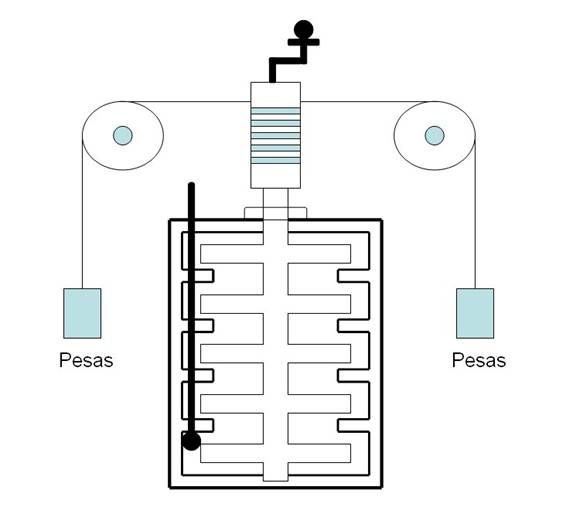
Explicación: al descender, las pesas realizan el trabajo mecánico: mueven las paletas transfiriendo energía cinética al agua. Al agitar el agua se observa un aumento en su temperatura.
1. En este enlace podrán ver la utilización de energía solar térmica para obtener agua caliente. Este sistema ecológico tiene muchas ventajas frente a los recursos utilizados en la actualidad, como la energía eléctrica o el uso de gas natural.
En grupos de seis alumnos, resuelvan las siguientes consignas. Luego, elaboren un informe en el programa Write de sus equipos portátiles.
- a) Expliquen cómo funciona el sistema que utiliza la energía solar térmica.
- b) ¿Qué porcentaje del agua utilizada se obtendrá a través de esta energía solar y cómo se obtiene el porcentaje restante?
- c) ¿Cómo afecta este sistema el clima y por qué?
- d) Se dice que este sistema es un proceso ecológico. Comenten qué ventajas tiene frente a los otros sistemas convencionales.
- e) La energía solar térmica es un tipo de energía que se denomina “pasiva”. Expliquen qué significa ese término.
- f) Investiguen sobre el concepto de “arquitectura bioclimática”.
- g) Busquen ejemplos de aplicación de transformación de energía mecánica en calor.
Actividad 2:
La cantidad de energía térmica requerida para elevar la temperatura de una sustancia varía para diferentes materiales.
La capacidad calorífica de un cuerpo es la relación entre el calor suministrado con respecto al correspondiente incremento de temperatura del cuerpo. Utilizando la letra Q para designar la cantidad de calor suministrado, la capacidad calorífica queda definida por:
![]()
Capacidad calorífica (Joule/C)
Calor específico de un material: es la cantidad de calor necesario para elevar un grado la temperatura de una unidad de masa.
![]()
Calor
específico
por lo tanto 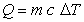 (Joule/(kg C))
(Joule/(kg C))
1. Con el programa Calc de OpenOffice que está en sus equipos portátiles, realicen los siguientes gráficos utilizando la tabla adjunta de calores específicos de diversas sustancias.
a) Calor específico vs calor necesario para elevar la temperatura de 250 gramos de masa de 20 ºC a 100 ºC.
b) Peso de Fe vs el calor necesario para elevar su temperatura de 20 ºC a 80 ºC, para los pesos: 10, 50, 70, 100, 130, 150, 200, 500, 700 y 1000 g.
|
SUSTANCIA |
CALOR ESPECÍFICO J/kg ºC |
|---|---|
|
ALUMINIO |
920 |
|
COBRE |
390 |
|
HIERRO |
470 |
|
MERCURIO |
140 |
|
PLOMO |
130 |
|
PLATA |
230 |
|
ACERO |
480 |
2. Con los gráficos elaborados, realicen un informe con el programa Write en el que incluyan las conclusiones de las variaciones halladas.
Actividad 3:
El calorímetro es un dispositivo que consiste en un recipiente metálico delgado, generalmente de aluminio, sostenido en su parte central y colocado dentro de una camisa externa por medio de un soporte de hule no conductor. La pérdida de calor se minimiza de tres maneras: el empaque de hule evita pérdidas por conducción, el espacio cerrado entre paredes del recipiente evita la pérdida de calor por corrientes de aire y el recipiente de metal muy bien pulido reduce la pérdida de calor por radiación. La tapa del recipiente tiene un orificio en la parte superior para poder introducir un termómetro y un agitador de aluminio.
1. Mediante el siguiente enlace pueden ver la medición de diversos calores medidos con un calorímetro convencional:
Sobre la base de lo observado, resuelvan el siguiente problema: en un experimento de laboratorio se utiliza un calorímetro para determinar el calor específico del hierro. Se colocan 80 g de balines de Fe seco en el recipiente y se calientan a 95 ºC. La masa del recipiente interior de aluminio con un agitador del mismo material es de 60 g. El calorímetro se llena parcialmente con 150 g de agua a 18 ºC. Los balines calientes se vacían rápidamente en el recipiente y se sella el calorímetro. Después de que el sistema ha alcanzado el equilibrio térmico, la temperatura final es de 22 ºC.
a) ¿Cuál es el calor específico del Fe? Tengan en cuenta que el calor perdido por los balines debe ser igual al calor ganado por el agua más el calor ganado por el recipiente y el agitador de aluminio.
Supongan que la temperatura inicial del recipiente es la misma que la del agua y la del agitador (18 ºC).