Soluciones (II). Propiedades de las soluciones
 |
Autores: Silvia Cerdeira, Helena Ceretti y
Eduardo Reciulschi. Responsable disciplinar:
Silvia Blaustein. Área disciplinar:
Química. Temática: Estados de la materia.
Soluciones. Nivel: Secundario, ciclo
orientado. Secuencia didáctica elaborada por Educ.ar.
|
|---|
Propósitos generales
• Promover el uso de los equipos portátiles en el proceso de enseñanza y aprendizaje.• Promover el trabajo en red y colaborativo, la discusión y el intercambio entre pares, la realización en conjunto de la propuesta, la autonomía de los alumnos y el rol del docente como orientador y facilitador del trabajo.
• Estimular la búsqueda y selección crítica de información proveniente de diferentes soportes, la evaluación y validación, el procesamiento, la jerarquización, la crítica y la interpretación.
Introducción a las actividades
Todos los líquidos poseen propiedades físicas que los caracterizan. Por ejemplo: la densidad, el punto de ebullición (la temperatura a la cual hierve), el punto de congelamiento, la viscosidad, etcétera.
En el caso de las soluciones –mezcla homogénea de un soluto y un solvente–, la presencia del soluto determina una modificación de las propiedades del solvente con relación a su estado puro.
Las propiedades coligativas de una solución son aquellas que dependen del número de partículas (moléculas, átomos o iones) disueltas en una cantidad fija de solvente.
Las propiedades coligativas son cuatro:
Diariamente, las personas se encuentran con situaciones que pueden explicarse mediante las propiedades coligativas, como las bebidas que se congelan a menor temperatura que el agua o los guisos que tardan en hervir mucho más que el agua de los fideos. Las propiedades coligativas también tienen gran importancia tecnológica, ya que a partir de su estudio pueden producirse:
• Odorizantes y perfumes con aromas más persistentes.
• Dispositivos para la purificación eficiente de aguas de consumo.
• Soluciones para la correcta nutrición de las plantas y para su uso adecuado en medicina.
Objetivos de las actividades
Que los alumnos:
• vinculen el efecto observado con las propiedades soluto-solvente a nivel molecular.
Actividad 1
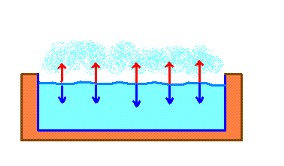
Una de las características más importantes de los líquidos es su capacidad para evaporarse, es decir, la tendencia de las partículas de la superficie del líquido a salir de la fase líquida en forma de vapor.
En la evaporación de líquidos hay ciertas moléculas próximas a la superficie con suficiente energía como para vencer las fuerzas de atracción del resto (moléculas vecinas) y así formar la fase gaseosa.
Las moléculas de la fase gaseosa que chocan contra la fase líquida ejercen una fuerza contra la superficie del líquido. Esta fuerza que actúa sobre un área determinada de la superficie del líquido se denomina presión de vapor. La presión de vapor se define como la presión ejercida por un vapor puro sobre su fase líquida cuando ambos se encuentran en equilibrio dinámico.
Cuanto más débiles son las fuerzas intermoleculares en el líquido, mayor cantidad de moléculas podrán escapar a la fase gaseosa.

¿Qué sucede si en lugar de un líquido puro tenemos una solución cuyo soluto es no volátil? Además de la interacción entre las partículas del solvente puro, se deben considerar también las interacciones entre soluto y solvente. Estas últimas dificultan la capacidad de las moléculas de solvente de pasar al estado gaseoso. En consecuencia, la presión de vapor será menor que la observada en el solvente puro.
Cuando la presión de vapor de un líquido iguala la presión atmosférica en un recipiente abierto, comienza la transición de fase del estado líquido al estado vapor, es decir, el líquido hierve.
Se utilizará lo explicado sobre las interacciones entre partículas para analizar lo que pasa con el punto de ebullición de una solución respecto del solvente puro. Probablemente hayan observado en la cocina que cuando se agrega sal a una olla con agua hirviendo, el hervor «desaparece» por unos minutos y se necesita darle más calor a la olla para que el agua vuelva a hervir. Esta energía extra que se necesita para que las moléculas de agua pasen al estado gaseoso está relacionada con las fuerzas intermoleculares presentes. En el caso del agua sola, las únicas fuerzas intermoleculares presentes serán las interacciones puente hidrógeno, dipolo-dipolo y las de dispersión. Cuando se agrega la sal, se producirán también interacciones entre los iones de la sal y las moléculas del agua (interacción ión-dipolo), las cuales retienen con más fuerza las moléculas de agua en estado líquido.
Vean la simulación Punto de ebullición y de
congelación, que aparece en la página Propiedades coligativas de las soluciones.
Ahora intenten verificar lo que vieron en la animación empleando materiales caseros.
Materiales
• Un recipiente para calentar.• Un mechero u hornalla.
• Agua.
• Sal.
• Una cuchara sopera.
• Un termómetro hasta 150 ºC con divisiones a 0,1 ºC (preferiblemente) o a 1 ºC.
Procedimiento
1. Coloquen 200 ml de agua en el recipiente y calienten hasta que hierva.
2. Coloquen el termómetro dentro del agua y midan la temperatura.
3. Agreguen una cucharada al ras de sal (unos 10 gramos). Revuelvan y vuelvan a calentar hasta que el agua hierva.
4. Coloquen nuevamente el termómetro y vuelvan a medir la temperatura.
5. Repitan el agregado de sal y la medición de la temperatura hasta que se observe sal sin disolver en el fondo del recipiente.
6. Transfieran los datos de cucharadas agregadas y de temperatura de ebullición a una tabla elaborada en el programa Calc y verifiquen gráficamente la relación entre la cantidad de sal agregada y la temperatura de ebullición. Si bien la correlación entre la variación de temperatura de ebullición es con la proporción de soluto por kg de solvente, la relación entre sal agregada y temperatura mostrará una tendencia similar sin necesidad de emplear equipamiento de laboratorio convencional.
Actividad 2
La transformación de un líquido a sólido se llama congelación y el proceso inverso se llama fusión. El punto de congelación (o solidificación) de un líquido corresponde a la temperatura a la cual las moléculas de un compuesto (por ejemplo, el agua) pasan del estado líquido al estado sólido. Este fenómeno se debe a que el movimiento molecular se va haciendo menor debido a la disminución de la temperatura, lo que favorece la aparición de estructuras moleculares ordenadas, características de los sólidos.
Si se disuelve un soluto en un solvente, se observará un descenso en el punto de congelación,es decir que la temperatura a la que se congela el solvente en la solución será menor a la temperatura a la que se congela el solvente puro.
En la época en que no existían otros métodos para enfriar bebidas o alimentos, la disolución de sales en agua era muy empleada con este fin y aún se sigue usando como método casero o en circunstancias en las cuales no se disponga de otros medios. Pueden ver un ejemplo de esto en el video «Cómo enfriar una bebida instantáneamente».
Otra manifestación de este fenómeno es el hecho de que una sustancia que está congelada puede ser derretida más fácilmente a temperatura ambiente si se la pone en contacto con sustancias iónicas o moleculares. Por ejemplo, agregando sal a la nieve, esta se funde y permite desbloquear caminos y casas.
Investiguen experimentalmente las afirmaciones anteriores.
Experimento 1
Para registrar este experimento deberán utilizar las cámaras de sus equipos portátiles. Este experimento funciona mientras haya hielo presente, por lo que hay que hacerlo bastante rápido.
Materiales
• Un vaso.• Una cuchara de sopa.
• Agua.
• Sal.
• Termómetro (hasta -15 ºC).
• Cubitos de hielo.
• Cloruro de amonio (opcional).
Procedimiento
1. Coloquen el termómetro dentro de un vaso. Luego agreguen agua y mucho hielo. Tomen una fotografía.
2. Fotografíen el dato de la temperatura cuando se estabilice. El termómetro marcará 0 ºC.
3. Agreguen una cucharada al ras de sal a la mezcla y vuelvan a fotografiar la temperatura cuando se estabilice.
4. Repitan el agregado de sal hasta que ya no se observen cambios en la temperatura.
5. Si en la escuela hay disponible cloruro de amonio, repitan la experiencia, pero en lugar de sal empleen esta última sustancia.
Experimento 2
Materiales
• 3 cubitos de hielo.• 3 recipientes.
• Sal.
• Azúcar.
• Una cuchara sopera.
Procedimiento
1. Coloquen en el primer recipiente una cucharada colmada de sal, en otro una cucharada de azúcar y, en el tercero, nada.
2. Coloquen un cubito de hielo en cada recipiente.
3. Con las cámaras de sus equipos portátiles, tomen fotografías de los tres recipientes con los cubitos al inicio del experimento y cada 5 minutos, hasta que el último hielo se haya derretido completamente.
4. ¿Cuál de las dos sustancias que emplearon sería más eficaz para derretir nieve?
a) Utilicen el programa Impress de sus equipos portátiles para realizar una presentación de la actividad que incluya las fotografías tomadas y una explicación sobre los fenómenos observados.
En lugares donde nieva mucho está muy difundido el empleo de sal para derretir la nieve de las calles para que los vehículos puedan circular. Si disponen de conexión a internet, investiguen qué problemas ambientales trae este procedimiento y qué alternativas se están estudiando.
Actividad 3
Los anticongelantes son productos químicos que se agregan al radiador de los motores para evitar que el agua hierva con las altas temperaturas del motor o se congele en caso de baja temperatura exterior. Algunas de sus características pueden apreciarse en el video «Anticongelantes».
Si disponen de conexión a internet, busquen las características de los diferentes anticongelantes (tipo de uso, componentes químicos, propiedades).
Webgrafía recomendada
Propiedades coligativas de las soluciones
Simulaciones
Boiling Point Elevation and Freezing Point Depression (en inglés)