Química orgánica (I)
 |
Autores: Silvia Cerdeira, Helena Ceretti y
Eduardo Reciulschi. Responsable disciplinar:
Silvia Blaustein. Área disciplinar:
Química. Temática: Química del carbono y
los grupos funcionales. Nivel: Secundario,
ciclo básico. Secuencia didáctica elaborada por Educ.ar.
|
|---|
Propósitos generales
● Promover el uso de los equipos portátiles en el proceso de enseñanza y aprendizaje.
● Promover el trabajo en red y
colaborativo, la discusión y el intercambio entre pares, la
realización en conjunto de la propuesta, la autonomía de los alumnos y
el rol del docente como orientador y facilitador del trabajo.
● Estimular la búsqueda y selección crítica
de información proveniente de diferentes soportes, la evaluación y
validación, el procesamiento, la jerarquización, la crítica y la
interpretación.
Introducción a las actividades
La vida en la Tierra está basada principalmente en un elemento: el carbono, hasta tal punto que no se conoce ningún compuesto relacionado con la vida en el que no esté presente (la única excepción podría ser el agua). El carbono presenta, entre otras, una propiedad química determinante: la capacidad de unirse entre sí para formar largas cadenas.
El estudio de la Química de las diversas cadenas de carbono ha resultado tan importante para la sociedad moderna, que se la ha llegado a considerar una rama de especialización de la química: Química orgánica.
Antiguamente, muchas de las sustancias que contenían carbono fueron consideradas como sustancias orgánicas, porque se creía que solo podían obtenerse de los organismos vivos. Incluso se consideraba que tenían una propiedad especial denominada «fuerza vital». Por otra parte, se llamaba sustancias inorgánicas a todas aquellas formadas por otros elementos que no fueran carbono y que se obtenían sin la intervención de los seres vivos. Pero, en 1828, Friedrich Whöler realizó un experimento que probó que la anterior clasificación era errónea. Logró transformar una sustancia inorgánica, el cianato de amonio, en una sustancia orgánica, presente en la orina de muchos animales: la urea.
Actualmente, esta clasificación ha quedado totalmente abandonada ya que en los últimos 150 años el ser humano ha sintetizado millones de moléculas orgánicas nuevas. Por lo tanto, se consideran sustancias orgánicas aquellas que contienen carbono en sus moléculas (se pueden mencionar algunas moléculas pequeñas que contienen este elemento y no son consideradas dentro de este grupo, como el monóxido y el dióxido de carbono).
En la vida cotidiana, las personas están rodeadas de moléculas orgánicas. Las fibras de las prendas (algodón, seda o poliéster), dentífricos, jabones, muebles, medicamentos, plásticos, alimentos, las moléculas esenciales para la constitución de un organismo vivo (proteínas, hidratos de carbono, lípidos)… Todas son orgánicas.
¿Por qué hay tantos compuestos que contienen carbono? Además de formar cadenas, el carbono tiene la capacidad de formar uniones simples, dobles y triples entre átomos de carbono vecinos. Además, en estas sustancias los átomos del carbono pueden acomodarse dando cadenas lineales y ramificadas, e incluso anillos.
Si quieren investigar un poco más acerca de qué sustancias son consideradas orgánicas y cuáles no, pueden consultar: Introducción a la química orgánica. En esta página se indica si el resultado es correcto o no.
Objetivos de las actividades
Que los alumnos:
• identifiquen diferentes compuestos de carbono: grupos funcionales;
• visualicen moléculas en tres dimensiones;
• relacionen estructura y propiedades.
Actividad 1
a) Busquen el número atómico del carbónico en la tabla periódica interactiva, que se puede descargar en EQTabla.
a.1) Deduzcan el número de protones y electrones en un átomo de dicho elemento.
a.2) Escriban la configuración electrónica (ver secuencia didáctica «Configuración electrónica») y deduzcan cuántos electrones necesita este elemento para completar el octeto (regla de Lewis).
Luego de realizar la actividad 1, es posible ver que el carbono puede formar cuatro enlaces covalentes (ver secuencia didáctica «Uniones covalentes I») para completar su último nivel energético. Estos enlaces pueden ser de tres tipos:
• enlaces covalentes simples (comparten un solo par de electrones entre los átomos),• enlaces covalentes dobles (comparten dos pares de electrones),
• enlaces covalentes triples (comparten tres pares de electrones).
b) Dibujen los diagramas de Lewis de las siguientes
moléculas (ver secuencia didáctica «Uniones
covalentes I»):
• C2H4
• C2H2
b.1) Predigan su geometría
utilizando los principios de la teoría de repulsión de enlaces de
valencia (TREPEV) (ver secuencia didáctica «Uniones covalentes (II)»).
b.2) Utilicen el programa Avogadro o ChemSketch, representen dichas moléculas y comprueben que llegaron a las conclusiones adecuadas.
c) Miren el video «Enlaces del carbono» para comparar sus resultados y
aprender algunas propiedades de los diferentes tipos de unión entre
átomos de carbono.
Actividad 2
La habilidad que tiene el carbono de formar uniones covalentes con otros átomos de carbono y con átomos de hidrógeno conduce a la formación de compuestos muy estables. Los compuestos que solo contienen los elementos carbono e hidrógeno son denominados hidrocarburos. Estos hidrocarburos pueden extraerse de los yacimientos de petróleo y gas natural (ver secuencia didáctica «El petróleo y sus derivados»). Ambos combustibles son mezclas de hidrocarburos. ¿Cómo se pueden clasificar los hidrocarburos?
El estudio de la gran cantidad de compuestos orgánicos se simplifica si se considera que están formados por un fragmento hidrocarbonado y un grupo de átomos que controlan la reactividad de la molécula. Este fragmento puede incluir o no otros elementos diferentes al carbono e hidrógeno, como por ejemplo oxígeno, nitrógeno, azufre, fósforo, algún halógeno o incluso combinaciones de estos unidos entre sí o con el carbono. A este grupo de átomos se lo denomina grupo funcional.
Este grupo funcional les otorga características particulares a los compuestos que lo contienen y es posible considerar a todas las moléculas que contienen el mismo grupo funcional como una familia. A estas familias se las denomina series homólogas. Una serie homóloga es un grupo de compuestos que tienen el mismo grupo funcional y, por lo tanto, presentan propiedades químicas similares y propiedades físicas que varían gradualmente a medida que aumenta el número de átomos de carbonos en la cadena. Por ejemplo: el etano y el propano pertenecen a la misma serie homóloga. Se los puede representar de distintas maneras, como puede observarse a continuación:
• Mediante la fórmula molecular: indicando la cantidad de carbonos e hidrógenos que forman una molécula. Ejemplo:C2H6, etano C3H8, propano
• Mediante la fórmula semidesarrollada: en ella se indica cómo los átomos de carbono e hidrógeno están agrupados. Ejemplo:CH3CH3 , etano CH3CH2CH3, propano
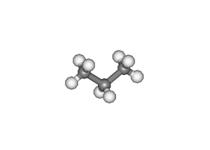
• Mediante la fórmula de esqueleto: en ella los átomos de carbono se representan como los vértices de segmentos de líneas que representan la unión entre átomos de carbono. Se supone que cada átomo de carbono está unido a la vez a tantos átomos de hidrógeno como sea necesario para que tenga cuatro enlaces en total (los átomos de hidrógenos se omiten en este tipo de fórmulas). Otros átomos distintos del C y el H o grupos radicales (R) deben escribirse de modo explícito. Ejemplo:
 |
 |
|
Etano |
Propano |
Los programas de representación de moléculas ayudan a visualizar estas diferentes formas de representación (por ejemplo, ACD/ChemSketch).
Pueden visitar: Grupos funcionales. Series homólogas para obtener más información acerca de grupos funcionales y series homólogas.
En el caso de los hidrocarburos, dependiendo de si las uniones entre carbonos son simples, dobles o triples, y contengan o no anillos (estructuras cíclicas) se pueden mencionar varias series homólogas que se resumen en la siguiente tabla:
Tabla 1. Hidrocarburos
|
Hidrocarburo |
Tipo de unión entre carbonos |
Ejemplo |
Fórmula general |
El nombre termina en |
Sitio para visualizarlos |
|---|---|---|---|---|---|
|
Alcanos |
Simple |
C2H6 etano |
CnH2n+2 |
-ano |
|
|
Alquenos |
Doble |
C2H4 eteno |
CnH2n |
-eno |
|
|
Alquinos |
Triple |
C2H2 etino |
CnH2n-2 |
-ino |
|
|
Ciclo alcanos |
Simple y anillo |
C6H12 ciclohexano |
CnH2n |
-ano |
|
|
Aromático |
Simple y doble, anillo |
C6H6 benceno |
- |
Como derivado del benceno |
En la tabla 1, n es el número de átomos de carbono que tiene la sustancia. El principio del nombre de un compuesto orgánico indica el número de átomos de carbonos que lo forman. Como se puede ver en la tabla 1, los tres primeros compuestos comienzan su nombre con et-, que señala que todos ellos contienen dos carbonos. La terminación de los mismos indica a qué serie homóloga pertenecen, por ejemplo: todos los alcanos terminan su nombre en -ano, como el metano (CH4) y el etano (C2 H6).
Parte A. Propiedades físicas de los hidrocarburos
Como vieron, existe un fuerte vínculo entre las fuerzas intermoleculares de un compuesto y sus propiedades físicas (ver secuencia didáctica «Fuerzas intermoleculares y propiedades físicas de las sustancias»). Ahora verán cómo se correlaciona este comportamiento en el caso de los hidrocarburos.
1. Determinen si la serie homóloga de los alcanos está formada por compuestos polares o no (ver secuencia didáctica «Uniones covalentes (III). Polaridad de enlaces y moléculas»). Fíjense en el resultado para el primer compuesto de la tabla anterior. ¿Cuáles son las fuerzas intermoleculares que actúan entre las moléculas de este compuesto? (Ver secuencia didáctica «Fuerzas intermoleculares y propiedades físicas de las sustancias»).
2. En la siguiente tabla se presentan los puntos de ebullición de algunos alcanos:
Tabla 2
|
Nombre |
Punto de ebullición ºC |
Número de átomos de carbonos |
|---|---|---|
|
Butano |
-0,5 |
4 |
|
Decano |
174,0 |
10 |
|
Etano |
-88,6 |
2 |
|
Heptano |
98,4 |
7 |
|
Hexano |
68,7 |
6 |
|
Metano |
-161,7 |
1 |
|
Nonano |
150,8 |
9 |
|
Octano |
125,7 |
8 |
|
Pentano |
36,1 |
10 |
|
Propano |
-42,1 |
3 |
a)
Utilicen el programa de hojas de cálculo, Calc o Excel, para hacer un
gráfico de punto de ebullición en función del número de átomos de
carbono. ¿Cómo depende el punto de ebullición del número de átomos de
carbono? ¿Qué tipo de fuerzas actúan entre estas moléculas? (ver
secuencias didácticas «Fuerzas intermoleculares y propiedades físicas de las
sustancias» y «Fuerzas intermoleculares (I)»).
Pueden comprobar sus resultados al visitar:
Puntos de ebullición de algunos alcanos
Puntos de ebullición de las moléculas orgánicas
b) ¿Esperan que estos compuestos sean solubles en agua?
¿Por qué? (ver secuencias didácticas «Fuerzas intermoleculares y propiedades físicas de
las sustancias» y «Fuerzas intermoleculares (I)» y «Solubilidad de sólidos»).
c) Corroboren la predicción realizada buscando la solubilidad en agua (por ejemplo, con el ChemSketch).
Parte B. Propiedades químicas de los hidrocarburos
Cuando se enciende una hornalla o se pone en marcha un auto, se producen reacciones exotérmicas. El gas de la cocina y la nafta para el auto son combustibles, es decir, sustancias que reaccionan con oxígeno produciendo energía. Estos combustibles son mezclas de hidrocarburos que, al reaccionar con oxígeno, forman dióxido de carbono y agua como productos finales (si la combustión es total) (ver secuencia didáctica «Termoquímica»).
Uno de los componentes del gas natural es el metano. La combustión de este hidrocarburo se puede representar mediante la siguiente ecuación:
CH4 (g) + 2O2 (g) --> CO2 (g) + 2H2O (g)
La reacción de combustión ocurre con todos los hidrocarburos mencionados anteriormente, liberando diferentes cantidades de energía.
Además de la reacción de combustión, los compuestos de la serie homóloga de los alcanos (denominados también compuestos saturados, por no tener dobles o triples enlaces) presentan una baja reactividad frente a otras sustancias. Es decir, las reacciones químicas en las que pueden participar no son muy variadas y se necesita mucha energía para producirlas.
En contraste, los hidrocarburos de las otras series homólogas (alquenos, alquinos, etc.), conocidos también como compuestos no saturados por contener uniones dobles y triples, pueden reaccionar con gran variedad de reactivos y adicionar otros elementos a su estructura.
A estas reacciones se las denomina reacciones de adición y, por ejemplo, son importantes en la obtención de plásticos (ver secuencia didáctica «El petróleo y sus derivados»).
La parafina es una mezcla de hidrocarburos saturados y se utiliza para fabricar velas. ¿Qué ocurre cuando se quema una vela? ¿Solo se derrite? ¿Ocurre una reacción química?
a) Sigan este procedimiento:
- Pesen una tapa metálica de algún frasco, por ejemplo, una tapa de mermelada, en una balanza.
- Coloquen sobre la tapa una vela pequeña y determinen su masa.
- Saquen la vela y la tapa de la balanza, apóyenlas sobre una mesada y enciendan la vela.
- Dejen que la vela se queme por un minuto. Enfríen y determinen nuevamente su masa (tomen la masa del conjunto de vela y tapa y luego determinen la masa de la vela descontando la tapa).
- Repitan la experiencia al menos 5 veces, tomando siempre los datos de masa en función del tiempo de quemado.
- Vuelvan a encender la vela y pongan a unos centímetros de la llama un vidrio de reloj (o recipiente adecuado de vidrio) con unos cubitos de hielo. Observen si ocurre algún cambio sobre la cara del vidrio cercana a la llama.
- Coloquen sobre la llama un embudo invertido cuyo vástago esté conectado a un tubo de látex. Dicho tubo de látex debe estar sumergido en una solución de agua de cal (solución saturada de hidróxido de calcio, cal apagada). Observen si esta se pone turbia.
Nota: el agua de cal reacciona con el dióxido de carbono mediante una reacción de neutralización:
Ca(OH)2 + CO2 --> CaCO3 + H2O y el carbonato de calcio, CaCO3, es insoluble en agua.
b) Utilicen las herramientas del programa Calc para obtener un gráfico de la masa de la vela en función del tiempo. ¿Qué relación existe entre ambas variables? ¿Se consume parte de la vela o no? ¿Se identificó algún producto en el último paso?
c) Para consultar acerca de experimentos de combustión, visiten las siguientes páginas:
Actividad 3
Formen grupos de tres o cuatro alumnos. Cada grupo va a elegir un trabajo de investigación en el que utilizarán los resultados de las actividades anteriores y también información obtenida de diferentes sitios de Internet, enciclopedias o diarios.
Trabajos de investigación
• Los diferentes componentes del petróleo crudo se separan por destilación fraccionada. ¿Por qué se selecciona este método de separación? Tomen como referencia la parte A de la actividad 2.• Uno de los gases responsables del efecto invernadero es el dióxido de carbono. ¿Cómo relacionan este efecto con la combustión de hidrocarburos? Tomen como referencia la parte B de la actividad 2.
• El petróleo es un recurso no renovable, al igual que los otros combustibles fósiles. ¿Qué otras fuentes alternativas de energía conocen?
Realicen una presentación con el programa Impress, de sus equipos
portátiles, para responder las preguntas y compartirlas con el resto de
la clase (también se puede utilizar la plataforma Squeak con este
propósito).
Webgrafía recomendada
Alótropos
del carbono (sitio en inglés)
Información de las distintas energías disponibilidad en el país
¿Cómo
se forma un gas natural?
El átomo de carbono y los enlaces orgánicos
Directorio de enlaces con información acerca de la química orgánica
El átomo de carbono y los enlaces orgánicos
Presentación PowerPoint: Principales grupos funcionales de la química orgánica