Obtención del aluminio
 |
Autores: Silvia Cerdeira, Helena Ceretti y
Eduardo Reciulschi. Responsable disciplinar:
Silvia Blaustein. Área disciplinar:
Química. Temática: Tecnología aplicada a la
obtención de materiales. Nivel: Secundario,
ciclo básico. Secuencia didáctica elaborada por Educ.ar.
|
|---|
Propósitos generales
• Promover el uso de los equipos portátiles en el proceso de enseñanza y aprendizaje.• Promover el trabajo en red y colaborativo, la discusión y el intercambio entre pares, la realización en conjunto de la propuesta, la autonomía de los alumnos y el rol del docente como orientador y facilitador del trabajo.
• Estimular la búsqueda y selección crítica de información proveniente de diferentes soportes, la evaluación y validación, el procesamiento, la jerarquización, la crítica y la interpretación.
Introducción a las actividades
La historia de la humanidad muestra que el empleo de algunos materiales metálicos como el bronce (aleación de cobre y estaño), el oro, la plata o el hierro, entre otros, ha estado presente desde tiempos muy remotos. Otros metales, sin embargo, son de uso mucho más reciente, por ejemplo el aluminio.
El aluminio es el tercer elemento en abundancia en la corteza terrestre (aproximadamente 8% m/m) después del oxígeno (47%) y el silicio (28%). ¿Por qué el metal más abundante en la corteza terrestre, tiene una historia de producción y desarrollo tan breve? Para dar respuesta a esta pregunta, se realizará una búsqueda de información y un análisis de sus procesos de obtención y propiedades.
Objetivos de las actividades
Que los alumnos:
• organicen información relacionada con el descubrimiento del aluminio y su desarrollo tecnológico;• reconozcan aplicaciones de procesos electroquímicos (electrólisis) en la obtención de materiales de interés industrial;
• reconozcan aspectos ambientales asociados con la producción y el reciclado del aluminio.
Actividad 1. Cronología del aluminio
Los comienzos de la historia del aluminio pueden situarse en Inglaterra en 1808, cuando Sir Humphry Davy reconoció la existencia de este metal y propuso llamarlo aluminio. El nombre deriva del término «alumbre», alúminosilicatos que empleaban los antiguos griegos y romanos con uso medicinal y en la fabricación de pigmentos.
En 1825, Hans Christian Oesterd logró obtener aluminio haciendo reaccionar cloruro de aluminio (AlCl3) con una amalgama de potasio y mercurio.
Hacia 1845, Friedrich Wöhler determinó algunas de las propiedades del metal, entre ellas su densidad.
En 1854, Henri Deville desarrolló un método comercial para obtener aluminio basado en el procedimiento de Oesterd. Sin embargo, el desarrollo de la industria del aluminio se inició recién en 1885, cuando Paul Héroult, en Francia, y Charles Hall, en Estados Unidos, obtuvieron el metal por electrólisis de la bauxita. La bauxita es un mineral rico en aluminio y debe su nombre a la región de Francia llamada Les Baux donde, en 1821, Pierre Berthier descubrió yacimientos de este metal.
Y en 1887, Karl Bayer patentó el proceso de obtención de alúmina (Al2O3) a partir de la bauxita. Al año siguiente, se fundaron en Francia, los Estados Unidos y Suiza las primeras compañías que produjeron aluminio por los procesos Bayer y Hall-Héroult.
Empleen el programa Cronos de sus equipos portátiles para elaborar una línea de tiempo, que ilustre la cronología del aluminio desde su descubrimiento hasta la actualidad. Busquen en internet o en una biblioteca los datos que necesiten.
Actividad 2. Obtención del aluminio: proceso primario
Aproximadamente, desde 1888, el aluminio se obtiene industrialmente por los procesos Bayer y Hall-Héroult, o proceso primario.
Proceso Bayer: purificación de bauxita, obtención de alúmina.
El mineral bauxita se muele y se trata con cal (CaO) en caliente. Por precipitación, se separa el material más grueso (arena). Se enfría la mezcla y precipita un sólido. Este se lava con agua. Luego se calcina (tratamiento a alta temperatura) y se obtiene finalmente la alúmina (Al2O3).
a) Empleen el programa Draw o CmapTools, o la opción de dibujo del procesador de textos de sus equipos portátiles, y hagan un diagrama de flujo que esquematice el proceso Bayer.
b) Busquen en Internet las zonas del planeta donde hay yacimientos de bauxita. Pueden comenzar por visitar la web de Aluar y la del Museo Geológico virtual de Venezuela.
c) Localicen en un planisferio las regiones donde se encuentran los yacimientos.
Proceso Hall-Héroult: electrólisis de la alúmina para obtener aluminio.
La clave para obtener aluminio consiste en reducir el catión Al3+ para formar Al°. El pasaje de corriente eléctrica a través de la celda de reacción (celda electrolítica) permite hacer esta transformación.
Recuerden que un compuesto iónico en estado sólido no conduce la corriente eléctrica. Los iones no pueden moverse libremente transportando carga eléctrica cuando están formando parte de la red cristalina. En cambio, sí pueden hacerlo en estado fundido.
La temperatura de fusión de la alúmina (Al2O3) es superior a los 1500 °C. El costo en energía y construcción de un reactor que opere a tan alta temperatura es muy elevado. Sin embargo, una mezcla de alúmina y criolita (Na3AlF6) funde a 1000 °C, aproximadamente. La criolita entonces actúa como fundente.
En la celda electrolítica tiene lugar la siguiente reacción:
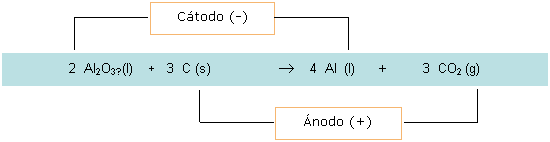 |
El carbono es el material que constituye el ánodo (electrodo positivo de la celda), y dado que se forma CO2 (g), este se va consumiendo, es decir, que las barras de carbono son un insumo en la producción del aluminio.
d) Enumeren las materias primas necesarias para obtener aluminio por el proceso primario.
e) Continúen el diagrama de flujo de la actividad 1, agregando un esquema del proceso Hall-Héroult.
f) Busquen en internet información sobre la producción industrial de aluminio por el proceso primario. En el caso de la Argentina, localicen geográficamente la planta de Aluar y la fuente de energía eléctrica que la abastece.
Actividad 3. Obtención de aluminio: proceso primario contra secundario (reciclado)
a) Busquen información en internet sobre los aspectos ambientales relacionados con la producción de aluminio por el proceso primario. Consideren el uso de los recursos naturales involucrados, el monitoreo y tratamiento de las emisiones gaseosas; el tratamiento de los residuos sólidos (rellenos de seguridad) y los efluentes líquidos. Pueden visitar, por ejemplo, la página de Aluar. Organicen la información obtenida en una tabla o diagrama/esquema con el programa Writer de sus equipos portátiles.
b) La producción secundaria de aluminio consiste básicamente en el reciclado de los materiales que cumplieron su ciclo de vida o restos de fabricación. Estos materiales se tratan en hornos de fundición que operan a una temperatura inferior a la requerida en la celda electrolítica del proceso Hall-Héroult. ¿Qué temperatura aproximadamente se requiere para fundir aluminio?
Pista: Pueden consultar la tabla periódica del programa ACD/ChemSketch Freeware 12.0.
c) La obtención de una tonelada de aluminio por el proceso primario requiere aproximadamente 50.400 MJ, mientras que para obtener la misma cantidad de metal por reciclado se consumen 12.000 MJ. ¿Qué porcentaje de energía eléctrica se ahorra al reciclar? Empleen la calculadora de sus equipos portátiles para hacer el cálculo.
d) Otra razón por la cual es viable el reciclado del aluminio reside en sus propiedades químicas, en particular, su resistencia a la corrosión. El aluminio puede ser utilizado y reutilizado sin sufrir deterioro. Si se compara el aluminio con el hierro, ¿sería factible reciclar objetos de hierro al igual que se hace con los objetos de aluminio?
Pista: comparen la resistencia a la corrosión de ambos metales.