
Esta actividad sugiere una serie de enlaces web que pueden ser reemplazados por otras fuentes y material bibliográfico.


La observación de diferentes reacciones químicas, a través de le experiencia. Los alumnos realizarán diversos experimentos empleando distintos métodos y catalizadores.
El agua oxigenada, que se utiliza para desinfectar heridas y decolorar el pelo –entre otros usos–, se descompone espontáneamente liberando oxígeno en burbujas. Esta reacción, que en condiciones normales ocurre lentamente, puede acelerarse agregando un catalizador, es decir, una sustancia que acelera reacciones químicas. Entre los catalizadores se encuentran compuestos inorgánicos, como el dióxido de manganeso, y biológicos –las enzimas–, como la catalasa que se obtiene de las papas y las manzanas. La actividad de las enzimas depende, entre otras cosas, de la acidez –o el pH– del medio.
Mediante la realización de este experimento se podrá determinar:
El agua oxigenada (H2O2) es una sustancia inestable, oxidante y muy tóxica. Su acción desinfectante y decolorante se debe a que oxida componentes de los microorganismos y colorantes. En las células se produce agua oxigenada en pequeña cantidad, como un subproducto de las reacciones bioquímicas de la respiración. El organismo se defiende de su toxicidad mediante los antioxidantes naturales que la descomponen en sustancias inocuas.
Espontáneamente, el agua oxigenada se descompone en agua y oxígeno de acuerdo con la siguiente ecuación:
Durante la reacción se liberan burbujas de oxígeno. En condiciones normales esto ocurre muy lentamente.
La velocidad de una reacción química es la cantidad de producto que esta genera, o la cantidad de reactivo que consume en una unidad de tiempo. Por lo tanto, la velocidad de descomposición del agua oxigenada puede medirse según la cantidad de oxígeno que se desprende, por ejemplo, en un minuto. Esto se logra midiendo el tiempo y el volumen de gas producido utilizando un tubo graduado.
En una reacción la energía de los reactivos y productos es siempre la misma, pero la energía de activación puede disminuir si un catalizador proporciona un camino alternativo para que proceda la reacción.
Los catalizadores disminuyen la barrera energética, o energía de activación, que deben superar los reactivos para transformarse en productos. Cuando la energía de activación es grande la reacción ocurre lentamente. Un catalizador aumenta la velocidad porque hace que la reacción ocurra mediante un mecanismo que requiere una energía de activación menor.
Los catalizadores pueden ser inorgánicos u orgánicos. Los catalizadores inorgánicos suelen ser metales de transición, como el platino y el níquel, o compuestos de metales de transición, como el dióxido de manganeso. Estas sustancias pueden combinarse con los reactivos y modificar la densidad electrónica en la unión química que se rompe durante la reacción. De esta manera se reduce la energía de activación y se facilita la reacción. En el caso de la descomposición del agua oxigenada, el catalizador debilita la unión entre los dos átomos de oxígeno (H-O-O-H), que se separan durante el proceso.
Las enzimas son catalizadores orgánicos de origen biológico y estructura compleja. La catalasa y la mayoría de las enzimas son proteínas, caracterizadas por su estructura molecular tridimensional. La actividad de las enzimas depende de esta estructura, en la cual hay una zona en la que se inserta una molécula del reactivo (o sustrato) de manera ajustada y específica, como puede hacerlo una llave en la cerradura. La unión del sustrato a la enzima desencadena la reacción química, se liberan los productos y el sitio de unión queda libre nuevamente para captar otra molécula de sustrato y continuar la reacción.
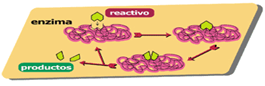
La enzima posee un sitio activo donde se une el sustrato. De esta manera facilita la reacción.
Una característica de las proteínas –y de las enzimas– es que su estructura tridimensional puede modificarse según la acidez del medio. La estructura que presentan se forma por el plegamiento de la cadena de aminoácidos de la proteína sobre sí misma. Estos plegamientos se forman por interacciones de tipo eléctrico que permiten la unión de aminoácidos, alejados entre sí en la secuencia lineal de la cadena. Las variaciones de la concentración de iones hidrógeno –o el pH–de la solución alteran la carga eléctrica de algunos grupos funcionales de los aminoácidos y afectan las interacciones que estos mantienen en la estructura tridimensional. Por este motivo, la actividad catalítica de una enzima, que requiere una estructura determinada, puede variar con el pH.
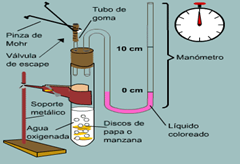
El oxígeno que se desprende a partir de la descomposición del agua oxigenada empuja la columna de líquido coloreado. El cronómetro se acciona cuando el líquido se encuentra en la marca 0 cm y se detiene cuando llega a 10 cm. En ese momento, la apertura de la válvula de seguridad permite que la columna de líquido descienda a la posición inicial.
|
pH |
Na2 HPO4 (cm3) |
Ácido cítrico (cm3) |
|
3,0 |
20,6 |
79,5 |
|
4,0 |
38,6 |
61,5 |
|
5,0 |
51,5 |
48,5 |
|
6,0 |
63,2 |
36,9 |
|
7,0 |
82,4 |
17,7 |
|
8,0 |
97,3 |
2,8 |
Calcular la velocidad de reacción.
Cuando el agua oxigenada se descompone se desprende oxígeno, que desplaza el líquido en el manómetro. La velocidad de la reacción puede expresarse como el volumen de oxígeno desprendido por unidad de tiempo:
Velocidad = volumen / tiempo
El volumen del gas desprendido, en el tiempo en que el líquido del manómetro llega desde la marca inicial a la de 10 cm, es igual al volumen del interior del tubo del manómetro entre las dos marcas.
Como el volumen que se mide es siempre el mismo en todo el experimento, se puede expresar la velocidad de reacción en unidades arbitrarias, reemplazando este volumen por un número cualquiera, por ejemplo 1.000 (así se obtienen números suficientemente grandes). Si el tiempo que tarda el líquido en alcanzar la marca superior se mide en segundos, entonces:
Velocidad (en unidades arbitrarias) = 1.000 / tiempo (en segundos)
|
pH |
Tiempo (segundos) |
Velocidad (unidades arbitrarias) |
|
3,0 |
||
|
4,0 |
||
|
5,0 |
||
|
6,0 |
||
|
7,0 |
||
|
8,0 |
Con los resultados obtenidos escribir un informe que contenga las siguientes partes.
Durante la realización de estas pruebas, proponoles a los alumnos que saquen fotos o filmen los distintos ensayos y luego editen un video con Movie Maker (programa de edición de videos instalado en los equipos). Si no cuentan con una cámara filmadora o de fotos, podrán utilizar las webcams que incluyen los equipos o un celular con cámara de fotos. Los alumnos deberán organizarse en grupos y distribuir los roles y tareas para realizar un trabajo colaborativo. Podrán compartir los archivos y documentos y organizar una biblioteca multimedia de ciencias y alojarla en la red de la escuela o en alguna de las máquinas.
En los dispositivos de los alumnos y en las notebooks de los docentes hay una serie de softwares educativos y quizás resulte oportuno utilizar el programa ACD/ChemSketch Freeware 12.0.