Solubilidad de sólidos
 |
Autores: Silvia Cerdeira, Helena Ceretti y
Eduardo Reciulschi. Responsable disciplinar:
Silvia Blaustein. Área disciplinar:
Química. Temática: Soluciones. Nivel:
Secundario, ciclo básico. Secuencia didáctica
elaborada por Educ.ar. |
|---|
Propósitos generales
- • Promover el uso de los equipos portátiles en el proceso de enseñanza y aprendizaje.
- • Promover el trabajo en red y colaborativo, la discusión y el intercambio entre pares, la realización en conjunto de la propuesta, la autonomía de los alumnos y el rol del docente como orientador y facilitador del trabajo.
- • Estimular la búsqueda y selección crítica de información proveniente de diferentes soportes, la evaluación y validación, el procesamiento, la jerarquización, la crítica y la interpretación.
Introducción a las actividades
En la vida diaria, las personas están acostumbradas a agregar sal (cloruro de sodio) al agua cuando cocinan, y también puede gustarles agregar azúcar al té o al café con leche, pero ¿cómo es qué se disuelven estos sólidos? ¿Cuánto sólido se puede poner hasta que no se disuelva más?
Para poder explicar de manera cuantitativa la capacidad de las
distintas sustancias para disolverse en un solvente dado, se empleará el
concepto de solubilidad.
La solubilidad es la cantidad
de soluto, en gramos, que puede disolverse en 100 g de agua a una
temperatura determinada.
La solubilidad se mide en cualquiera de las unidades usadas para expresar la composición de una solución, es decir, en moles de soluto por litro de solución, gramos de soluto por litros de solución, etcétera.
Dependiendo de la cantidad de soluto que se agregue, se puede clasificar a las soluciones como insaturadas: si se agrega menor cantidad que la indicada por la solubilidad; saturadas: si se agrega exactamente la cantidad indicada por la solubilidad y sobresaturadas: es una solución que contiene una cantidad de soluto disuelto mayor a la solubilidad. Esta última es una situación inestable, de manera que basta la adición de poca cantidad de soluto o la agitación de la solución.
Objetivos de las actividades
Que los alumnos:
- • exploren cuantitativamente la solubilidad de sales en agua;
- • verifiquen la variación de la solubilidad con la temperatura.
Actividad 1. Determinación de la solubilidad molar de un compuesto
Si bien en la solubilidad influyen varios factores (como los balances energéticos y el desorden global del sistema), esta actividad se centrará en analizar qué es lo que sucede con la interacción entre las partículas de soluto y solvente.
Un sólido iónico, como la sal de mesa (NaCl), se disuelve cuando sus iones interaccionan con los dipolos de un solvente polar (interacción ión-dipolo) venciendo las fuerzas de atracción ión–ión del soluto.
Un sólido molecular con uniones covalentes polares, como el azúcar (sacarosa), se disuelve cuando sus dipolos interaccionan con los dipolos de un solvente polar de un modo comparable al que lo harían las partículas del sólido entre sí.
La combinación de estos factores que operan a nivel molecular constituye un límite de cuánto puede disolverse una sustancia en otra, a una temperatura dada. Este límite o «solubilidad» puede expresarse en términos de la concentración molar –solubilidad molar– o como solubilidad en g/100 gramos de solvente.
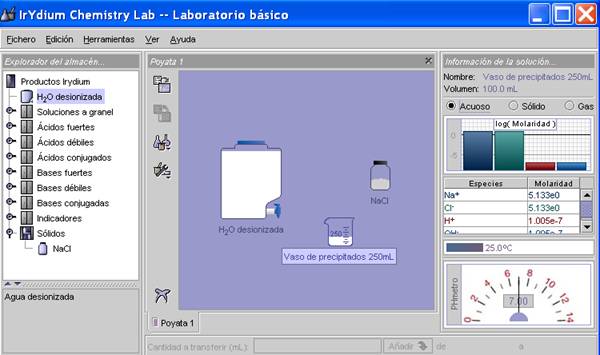
- a.1) Abran el programa Virtual Lab. > Seleccionen «Vaso de precipitados de 250 ml». > Seleccionen «agua destilada» y «agregar 100 ml» al vaso de precipitados. > Seleccionen «NaCl» de la carpeta de sólidos > «agregar 10 gramos (solución insaturada)».
-
- a.2) Verifiquen la concentración molar de los iones Na+ y Cl– en la «información de la solución» opción «acuoso». Tomen nota del valor de concentración.
-
- a.3) Verifiquen si hay sólido sin disolver seleccionando la opción «sólido» en la «información de la solución». Tomen nota si hay un sólido sin disolver y, si lo hubiera, cuál es la cantidad.
-
- a.4) Anoten la temperatura que aparece arriba del termómetro (inicialmente el agua está a 25 ºC).
-
- a.5) Repitan los pasos a.2, a.3 y a.5 hasta que aparezca alguna cantidad de sólido sin disolver. Entonces, anoten aparte la solubilidad de los iones, que será la solubilidad molar, y la temperatura.
Nota: Este ejercicio se continuará en la actividad siguiente, por lo que es recomendable mantener el Virtual Lab abierto.
- b) En el programa Calc de sus equipos portátiles, armen una tabla con los datos de los agregados de sal en una columna, la concentración molar de iones de sodio (Na+) y de cloruro (Cl-) en las siguientes, luego la cantidad de sólido y, por último, la temperatura después de cada agregado. La relación entre la masa y la molaridad de los iones puede consultarse en la secuencia didáctica «Soluciones I».
 |
Actividad 2. Efecto de la temperatura sobre la solubilidad
La solubilidad depende de la temperatura. En el caso de los sólidos, un buen indicativo de esta dependencia es observar si cuando estos se disuelven en agua, la solución resultante se enfría o se calienta.
Si cuando se disuelve un sólido se verifica una disminución de la temperatura, significa que si se aumenta la temperatura del sistema, la solubilidad va a aumentar. Por el contrario, si cuando se disuelve una sal en un solvente se verifica un aumento de la temperatura, significa que si se calienta el agua, se podrá disolver menos soluto, es decir que la solubilidad va a disminuir.
• Comprueben lo que se dijo en los párrafos anteriores continuando con el ejercicio del Virtual Lab del vaso de precipitados con la sal.
- Vayan a la solapa «herramientas/instrumentos» > seleccionen «Mechero Bunsen».
- En la ventana «información de la solución», que está a la derecha, coloquen la opción «sólido» (es el que tienen en el fondo del vaso) > Acerquen el mechero al vaso de precipitados; en el termómetro de la derecha se observará un incremento de la temperatura del vaso. > Verifiquen que a medida que aumenta la temperatura, la cantidad de sólido sin disolver disminuya.
-
- Una vez que el sistema haya llegado a los 80 ºC, retiren el mechero y permitan que el sistema se enfríe. Verifiquen que nuevamente comience a incrementarse la cantidad de sólido en el fondo.
- Repitan el procedimiento, pero en la ventana «información de la solución» coloquen la opción «acuoso». Verifiquen el comportamiento de la concentración de los iones respecto de la temperatura.
Actividad 3. Aplicaciones de la sal
Busquen en internet qué tipo de industrias usan la sal, y si la emplean sólida o en solución. Verifiquen dónde se encuentran los yacimientos de sal más importantes de la Argentina y cuál es el régimen de lluvias que hay en la zona de los yacimientos.
Teniendo en cuenta que otra fuente importante de sal es la del agua de mar, cuya concentración de sal es de aproximadamente 3,5%. ¿Qué pasaría si cambiara el régimen de lluvias en las zonas de los yacimientos?